pH en el agua
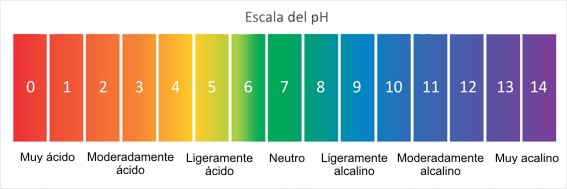
El agua potable o mineral se considera agua que puede ser consumida por personas y animales sin riesgo de contraer enfermedades, su pH varia de 6.5 a 8.5. Ademas generalmente las aguas que se venden en los mercados tienen pH de 5 a 6.5. Cuando es alcalina es porque contiene mas de 600 ml/l de iones de bicarbonato o mas de 250 mg/l de dióxido de carbono libre. En el agua mineral comercial se incluyen los siguientes iones: calcio, magnesio, sodio, potasio, bicarbonato, sulfato y flúor.
De todos estos minerales, solo el bicarbonato y el flour no son fuertes, siendo los únicos que pueden reaccionar con el agua.
Bicarbonato:
Bicarbonato:
HCO3⁻ + H20 = H2C03 + OH⁻
Fluor:
F⁻ + H2O = HF + OH⁻
En consecuencia, siendo estas dos iones bases conjugadas, el pH va a ser mayor a 7, porque hay mas oxidrilos que hidronios.
El pH del agua pura (H20) es 7 a 25 °C, pero cuando se expone al dióxido de carbono en la atmósfera este equilibrio resulta en un pH de aproximadamente 5.2. Debido a la asociación de pH con los gases atmosféricos y la temperatura.
El agua de los ríos de llanuras suele tener el pH ácido, entre 5 y 6. La de napas subterráneas, según la zona, puede ser más elevado, de 7 a 8,5. También es elevado el pH del agua de montaña.
Por ejemplo, aca hay una muestra de niveles de pH de agua de pozo. Como claramente se puede ver, esta tiene pH mayor a 7.
En aguas con pH inferior a 8.3, la mayoria de las aguas subterráneas naturales, la especie carbonatada dominante es el ión bicarbonato, En estas aguas la concentración de HCO3- suele variar entre 50 y 400 mg/l aunque puede alcanzar valores de hasta 800 mg/l. Concentraciones de hasta 1000mg/l. de HCOj pueden encontrarse en aguas pobres en Ca" y Mg" o en las que se producen fenómenos de liberación de C02 en el acuífero.
Los iones fundamentales son
En las piletas si el pH esta demasiado alto, disminuye la eficacia del cloro. El pH del agua de las piletas debe estar en un valor de 7,2 a 7,6; si el valor esta por encima de 7,7 o más deberá disminuirse, ya que en esos valores la efectividad del cloro como germicida es muy baja y el agua puede enturbiarse como consecuencia de reacciones químicas indeseables entre el cloro agregado y los componentes naturales del agua. Si el valor del pH estar por debajo de 7,2 el cloro no se mantiene en el agua y tiende a volatilizarse mas rápido, lo que obligara a agregados mas frecuentes y la posible descomposición, del agua, y además el agua se torna corrosiva.
El agua oceánica es ligeramente alcalina, y el valor de su pH está entre 7.5 y 8.4 y varía en función de la temperatura; si ésta aumenta, el pH disminuye y tiende a la acidez; también puede variar en función de la salinidad, de la presión o profundidad y de la actividad vital de los organismos marinos.
Los iones que se encuentran en el agua oceanica son Cl-, Na+, SO42-, K+, Ca2+, Mg2+, HCO3-
El agua de lluvia pura normalmente tiene un pH cercano a 5.6; es levemente ácida por el contenido de anhídrido carbónico en la atmósfera. La niebla, en cambio, se sitúa alrededor de los 4,5. Los contaminantes que las acidifican son principalmente el dióxido de azufre (S02) y los óxidos de nitrógeno.
Agua dura es la que contiene exceso de sales y forma poca espuma con el jabón, contiene iones calcio y magnesio y es inadecuada para algunos usos domésticos e industriales.
La dureza del agua se expresa como mg/l de carbonato de calcio (CaCO3).
Muchos manantiales de agua, son duros, generalmente en las regiones donde de existen depósitos de caliza. Por el CO2 de la atmosfera, el agua de lluvia se puede considerar con una disolución diluida de ácido carbónico:
Dicha disolución, va poco a poco disolviendo la roca caliza:
Como consecuencia, aumenta el contenido de calcio en el agua, produciendo la llamada agua dura.
La secuencia de equilibrios de disolución de CO2 en un agua, y la disolución de carbonatos e insolubilización de bicarbonatos, alteran el pH del agua.
El agua destilada o gasificada tiene pH menor a 7. Esta ligera disminución del pH es debido no al proceso de destilación o composición química del agua sino que al exponer el agua destilada con el aire comienza a absorber el CO2 del ambiente y de esta manera comienza a disminuir su pH.
H2O + CO2 ---> H2CO3
El agua de los ríos de llanuras suele tener el pH ácido, entre 5 y 6. La de napas subterráneas, según la zona, puede ser más elevado, de 7 a 8,5. También es elevado el pH del agua de montaña.
En lagos y embalses genaralmente el pH es alrededor de 6.5, pero esta relacionada con la dinámica térmica del lago, y disminuye con la profundidad. Esto sucede porque, las zonas profundas son pobres de O2 y tienen muchos microorganismos reductores. Las aguas superficiales tienen un valor de pH entre 6 a 8.5, dejando a las aguas subterráneas con menores valores de pH.
Los vertedores industriales tienen diferentes valores en función de la actividad industrial que los genera: agua de minería, industrias metalúrgicas e industrias químicas suelen tener carácter ácido y por contra, aguas de minas calcáreas exhiben carácter básico.
Los vertedores industriales tienen diferentes valores en función de la actividad industrial que los genera: agua de minería, industrias metalúrgicas e industrias químicas suelen tener carácter ácido y por contra, aguas de minas calcáreas exhiben carácter básico.
Por ejemplo, aca hay una muestra de niveles de pH de agua de pozo. Como claramente se puede ver, esta tiene pH mayor a 7.
En aguas con pH inferior a 8.3, la mayoria de las aguas subterráneas naturales, la especie carbonatada dominante es el ión bicarbonato, En estas aguas la concentración de HCO3- suele variar entre 50 y 400 mg/l aunque puede alcanzar valores de hasta 800 mg/l. Concentraciones de hasta 1000mg/l. de HCOj pueden encontrarse en aguas pobres en Ca" y Mg" o en las que se producen fenómenos de liberación de C02 en el acuífero.
Los iones fundamentales son
- Cloruro Cl⁻ Sodio Na⁺
- Sulfato SO4²⁻ Calcio Ca²⁺
- Bicarbonato CO3H⁻Magnesio Mg⁺
En las piletas si el pH esta demasiado alto, disminuye la eficacia del cloro. El pH del agua de las piletas debe estar en un valor de 7,2 a 7,6; si el valor esta por encima de 7,7 o más deberá disminuirse, ya que en esos valores la efectividad del cloro como germicida es muy baja y el agua puede enturbiarse como consecuencia de reacciones químicas indeseables entre el cloro agregado y los componentes naturales del agua. Si el valor del pH estar por debajo de 7,2 el cloro no se mantiene en el agua y tiende a volatilizarse mas rápido, lo que obligara a agregados mas frecuentes y la posible descomposición, del agua, y además el agua se torna corrosiva.
El agua oceánica es ligeramente alcalina, y el valor de su pH está entre 7.5 y 8.4 y varía en función de la temperatura; si ésta aumenta, el pH disminuye y tiende a la acidez; también puede variar en función de la salinidad, de la presión o profundidad y de la actividad vital de los organismos marinos.
Los iones que se encuentran en el agua oceanica son Cl-, Na+, SO42-, K+, Ca2+, Mg2+, HCO3-
El agua de lluvia pura normalmente tiene un pH cercano a 5.6; es levemente ácida por el contenido de anhídrido carbónico en la atmósfera. La niebla, en cambio, se sitúa alrededor de los 4,5. Los contaminantes que las acidifican son principalmente el dióxido de azufre (S02) y los óxidos de nitrógeno.
Agua dura es la que contiene exceso de sales y forma poca espuma con el jabón, contiene iones calcio y magnesio y es inadecuada para algunos usos domésticos e industriales.
La dureza del agua se expresa como mg/l de carbonato de calcio (CaCO3).
Muchos manantiales de agua, son duros, generalmente en las regiones donde de existen depósitos de caliza. Por el CO2 de la atmosfera, el agua de lluvia se puede considerar con una disolución diluida de ácido carbónico:
CO2 (g) + H2O → H2CO3
H2CO3 → H⁺+ HCO3⁻
H⁺ + CaCO3(s) → HCO3⁻ + Ca²⁺
Así, cuando hay mucha cal (cuando el agua es muy dura), las moléculas de jabón empiezan a asociarse con estos iones y las micelas se rompen o no llegan a formarse. Por lo tanto, en zonas con aguas muy duras, los jabones formarán menos espuma y lavarán menos.
R-COONa + Ca²⁺ = Ca (R - COO)2 + 2Na
El jabón es una sal, pero es insoluble. Por esto, el jabon no se puede disolver en agua dura y es necesario usar mas jabón.El ablandador de agua es un aparato o dispositivo encargado de eliminar químicamente las sales de calcio y magnesio de un sistema de abastecimiento, generalmente mediante un intercambio de iones.
Otras forma de realizar el ablandamiento es la de “adición de carbonato sódico”, que conlleva la eliminación de Ca2+ mediante la reacción:
Ca²⁺ + CO3²⁻ == CaCO3 (precipitado)
La lluvia ácida tiene un pH entre 4.0 y 4.4. Éste se crea porque el dióxido de azufre (SO2) emitido por los volcanes , al reaccionar con el aire se oxida transformándose a trióxido de azufre, lo cual se da a través de dos procesos químicos. Uno de ellos es combinándose con el ozono ( O3 ) presente en la atmósfera:
SO2 + O3 SO3 + O2 = Trióxido de Azufre
 Otro proceso es combinándose el dióxido de azufre (SO2) con el oxígeno atmosférico ( O2 ) que actúa como catalizador de las partículas sólidas (aerosoles) suspendidas en el aire:
Otro proceso es combinándose el dióxido de azufre (SO2) con el oxígeno atmosférico ( O2 ) que actúa como catalizador de las partículas sólidas (aerosoles) suspendidas en el aire:
SO2 + O2 2SO3 = Trióxido de Azufre
El trióxido de azufre reacciona con el agua de las nubes, generándose ácido sulfúrico, que luego precipita como lluvia ácida. De esta reacción resulta el ácido sulfúrico ( H2 SO4) como contaminante atmosférico, de la manera siguiente:
SO3 + H2O H2 SO4
Una vez formados los óxidos SO3 y NO2, reaccionan con facilidad con la humedad atmosférica para formar los ácidos sulfúrico y nítrico respectivamente. Estos permanecen disociados en la atmósfera y le imparten características ácidas y, eventualmente, se precipitan con la neblina, la lluvia o la nieve, las que, por lo tanto, tendrán mayor acidez en las áreas que reciben continuamente dichos óxidos que en las que no están alteradas.
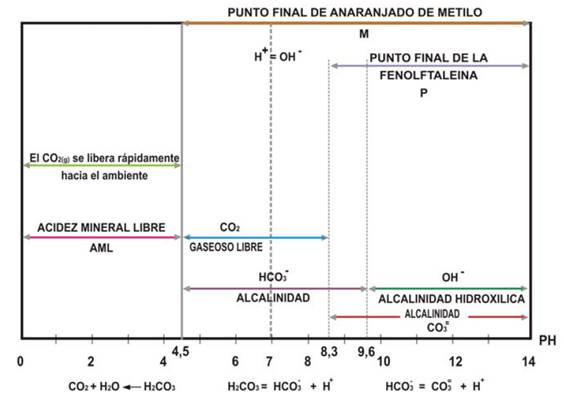
LA ALCALINIDAD
Significa la capacidad tapón del agua; la capacidad del agua de neutralizar.
Evitar que los niveles de pH del agua lleguen a ser demasiado básico o ácido. La alcalinidad estabiliza el agua en los niveles del pH alrededor de 7. Sin embargo, cuando la acidez es alta en el agua la alcalinidad disminuye, puede causar condiciones dañinas para la vida acuática.La alcalinidad se debe en mayor parte por el CO2 que absorbe el agua en su trayecto o estancada.
Los compuestos que más contribuyen a la alcalinidad son los bicarbonatos, ya que se forman fácilmente por la acción del dióxido de carbono atmosférico sobre los materiales constitutivos de los suelos en presencia de agua, a través de la siguiente reacción:
CO2 + CaCO3 + H2O → Ca2+ + 2HCO3-
Es decir que las aguas adquieren su alcalinidad por medio de la disolución de minerales básicos carbonatados, los que además aportan al medio sus cationes mayoritarios, como Ca2+, Mg2+, Na+ y K+.
LA ALCALINIDAD
Significa la capacidad tapón del agua; la capacidad del agua de neutralizar.
Evitar que los niveles de pH del agua lleguen a ser demasiado básico o ácido. La alcalinidad estabiliza el agua en los niveles del pH alrededor de 7. Sin embargo, cuando la acidez es alta en el agua la alcalinidad disminuye, puede causar condiciones dañinas para la vida acuática.La alcalinidad se debe en mayor parte por el CO2 que absorbe el agua en su trayecto o estancada.
Los compuestos que más contribuyen a la alcalinidad son los bicarbonatos, ya que se forman fácilmente por la acción del dióxido de carbono atmosférico sobre los materiales constitutivos de los suelos en presencia de agua, a través de la siguiente reacción:
CO2 + CaCO3 + H2O → Ca2+ + 2HCO3-
Es decir que las aguas adquieren su alcalinidad por medio de la disolución de minerales básicos carbonatados, los que además aportan al medio sus cationes mayoritarios, como Ca2+, Mg2+, Na+ y K+.
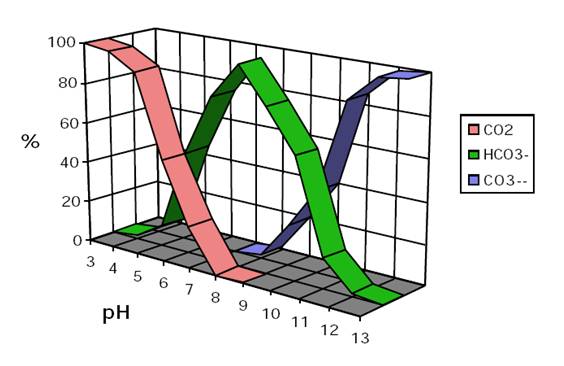
Existe una relación entre la alcalinidad, el pH y los iones presentes:
- El efecto del pH en la concentración de especies carbonatas en el agua:
Fuentes:
http://aguas.igme.es/igme/publica/libro43/pdf/lib43/1_1.pdf
http://www4.ujaen.es/~mjayora/docencia_archivos/Quimica%20analitica%20ambiental/tema%2010.pdf




Comentarios
Publicar un comentario